全球醫(yī)療器械UDI合規(guī)-下篇
10
中國(guó)UDI要求:
中國(guó)目前的要求包括對(duì)更復(fù)雜的設(shè)備進(jìn)行UDI標(biāo)記��,還有更多的設(shè)備類(lèi)別有待解決���。除了標(biāo)簽要求外����,中國(guó)還要求將UDI作為醫(yī)療器械注冊(cè)的一部分進(jìn)行記錄��。

11
新加坡UDI要求:
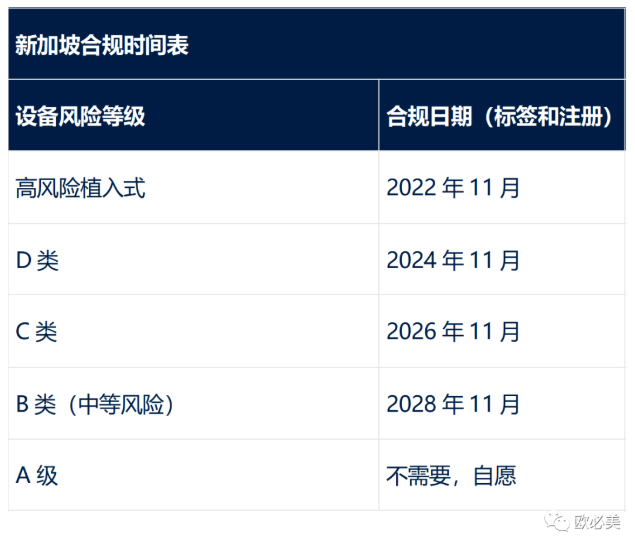
新加坡目前不要求遵守UDI標(biāo)簽或數(shù)據(jù)庫(kù)注冊(cè)法規(guī)��。當(dāng)要求生效時(shí)�����,新加坡將接受已在美國(guó)和歐盟銷(xiāo)售的設(shè)備的UDI標(biāo)簽,否則UDI將需要遵守新加坡的所有HSA指南����,包括與HSA指定的UDI發(fā)行實(shí)體合作。
新加坡還允許企業(yè)在以下列出的截止日期前�����,對(duì)進(jìn)口的醫(yī)療器械給予6個(gè)月的寬限期����。因此��,例如�����,一家擁有高風(fēng)險(xiǎn)植入式設(shè)備的公司���,要求在2022年11月進(jìn)行UDI標(biāo)記和注冊(cè)�,則可以在2023年5月1日之前繼續(xù)銷(xiāo)售不符合UDI標(biāo)準(zhǔn)的設(shè)備(允許在合規(guī)日期之前耗盡當(dāng)?shù)貛?kù)存)�����。
12
韓國(guó)UDI要求:
韓國(guó)已經(jīng)對(duì)大多數(shù)設(shè)備類(lèi)實(shí)施了UDI標(biāo)簽和數(shù)據(jù)庫(kù)注冊(cè)要求,只有一個(gè)類(lèi)別尚未完成����。作為引入U(xiǎn)DI的一部分,韓國(guó)還要求制造商提供設(shè)備月度供應(yīng)歷史報(bào)告��,要求從UDI合規(guī)日期起1年���。
請(qǐng)注意����,韓國(guó)法規(guī)中提到的是“綜合醫(yī)療器械信息系統(tǒng)”����,即IMDIS(即UDI數(shù)據(jù)庫(kù));以及“醫(yī)療器械標(biāo)準(zhǔn)代碼”����,即UDI代碼本身。

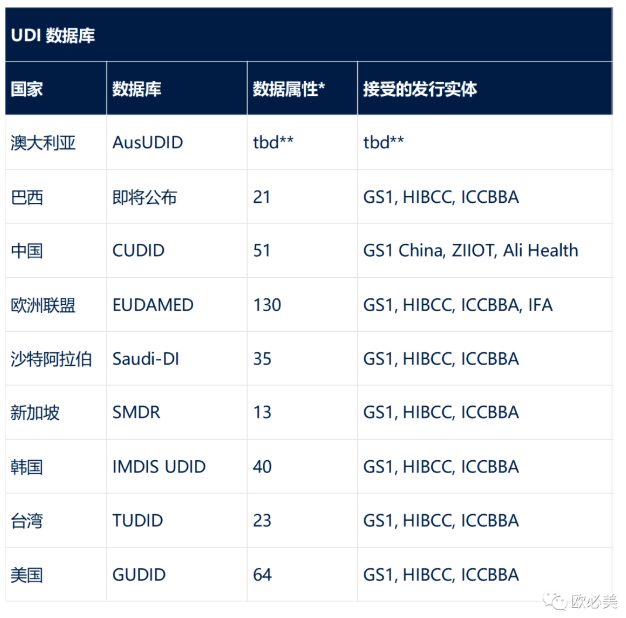
特定國(guó)家UDI數(shù)據(jù)庫(kù)UDI要求:
每個(gè)國(guó)家都有自己的UDI數(shù)據(jù)庫(kù)��,對(duì)這些數(shù)據(jù)庫(kù)中存儲(chǔ)的數(shù)據(jù)有不同的要求。在不同的UDI數(shù)據(jù)庫(kù)中���,所需的數(shù)據(jù)存在重疊�����,但每個(gè)國(guó)家也有其所需的獨(dú)特?cái)?shù)據(jù)�。
此外����,各國(guó)要求UDI-DI信息由“發(fā)布實(shí)體”提供。請(qǐng)注意����,所有國(guó)家均接受GS1作為發(fā)布實(shí)體。