- 首頁(yè)
-
國(guó)際項(xiàng)目
美國(guó)US歐盟EU更多國(guó)家
- 老撾注冊(cè) |
- 緬甸注冊(cè) |
- 埃塞俄比亞注冊(cè) |
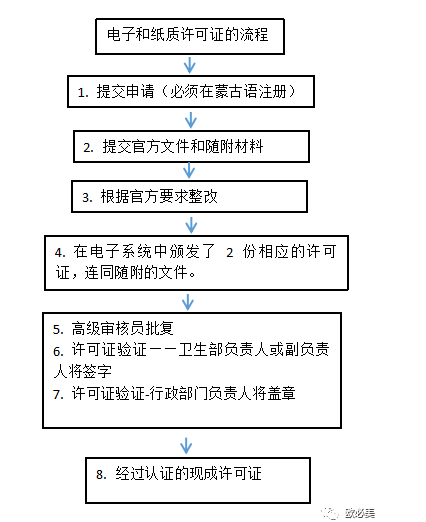
- 蒙古注冊(cè) |
- 產(chǎn)品檢驗(yàn)檢測(cè) |
- 韓國(guó)注冊(cè) |
- 巴西注冊(cè) |
- 澳大利亞注冊(cè) |
- 泰國(guó)注冊(cè) |
- 日本注冊(cè) |
- 新加坡注冊(cè) |
- 菲律賓注冊(cè) |
- 馬來(lái)西亞注冊(cè) |
- 越南注冊(cè) |
- 印度尼西亞注冊(cè) |
- 沙特注冊(cè) |
- 東南亞聯(lián)盟十國(guó)注冊(cè) |
- 哥倫比亞注冊(cè) |
- 加拿大注冊(cè) |
- 中國(guó)臺(tái)灣注冊(cè) |
- 墨西哥注冊(cè) |
- 俄羅斯注冊(cè) |
- 印度注冊(cè) |
- 瑞士注冊(cè) |
- 英國(guó)注冊(cè) |
- 中國(guó)項(xiàng)目
- 新聞資訊
- 關(guān)于我們
- 聯(lián)系我們
400-0569-812