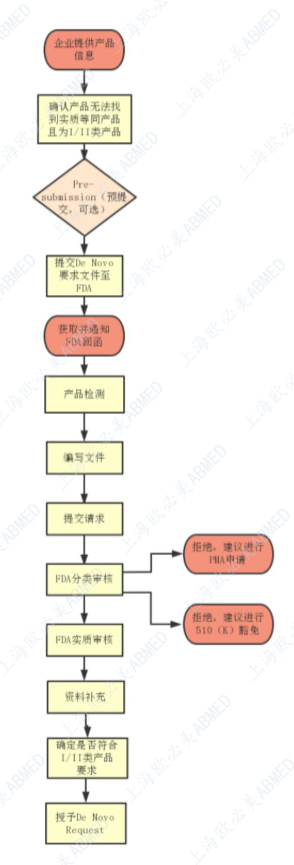
FDA De Novo分類請求的申請流程
De Novo路徑提供了一種上市許可途徑�����,適用于沒有前代產(chǎn)品的器械分類,也不需要提交PMA流程的情形。通過審評相關(guān)證據(jù)�����,如發(fā)現(xiàn)該醫(yī)療器械的風(fēng)險通過常規(guī)控制措施或者特殊控制措施即可保證醫(yī)療器械的安全有效性�����,則該醫(yī)療器械可被分類為I類或者II類(III類進(jìn)行PMA申請)����。
通過De Novo分類請求被分類為I類或II類的設(shè)備可被上市,并可用作未來510(k)提交的比對產(chǎn)品(如適用)�����。
在向FDA提交De Novo申請之前���,F(xiàn)DA建議申請者先考慮進(jìn)行預(yù)提交pre-sub��,提前溝通其所需要提交的支持De novo 分類的額外信息�,以促進(jìn)整個流程更高效���。
有兩種選擇可以向FDA提交De Novo請求,以便對分類為I類或II類中低風(fēng)險器械進(jìn)行基于風(fēng)險的評估�����。
途徑1:在收到針對510(k)提交的非實(shí)質(zhì)性等同(NSE)確定(即����,無比對器械���、新的預(yù)期用途或引發(fā)不同安全性和有效性問題的不同技術(shù)特征)后。
途徑2:確定沒有合法銷售的器械可作為實(shí)質(zhì)等效性(SE)的確定依據(jù)��。