一、泰國主管機(jī)構(gòu)及法規(guī)要求:
泰國是東南亞主要的醫(yī)療器械市場(chǎng)之一��。泰國的醫(yī)療器械受泰國公共衛(wèi)生部 (MOPH) 下屬的泰國食品和藥物管理局 (TFDA) 監(jiān)管�。
2021年��,泰國食品和藥品管理局(TFDA)修訂了其醫(yī)療器械法規(guī)���。根據(jù)舊法規(guī)(2008 年醫(yī)療器械法 (BE 2551)) ,90%的器械被歸類為通用器械��,不需要TFDA詳細(xì)審查�。相反,修訂后的法規(guī)(醫(yī)療器械法/條例 BE 2562 (2019) (第二版))��,與東盟地區(qū)醫(yī)療器械指令(AMDD)一致�����,大多數(shù)器械現(xiàn)在處于TFDA的審查之下�����,需要通知或注冊(cè)���。
二����、產(chǎn)品分類
醫(yī)療器械分為四 (4) 類——I、II�、III 和 IV。新法規(guī)還包括分組規(guī)則�,允許將醫(yī)療設(shè)備和 IVD 分組。醫(yī)療器械分組是將相關(guān)產(chǎn)品組合在一起并在同一申請(qǐng)中注冊(cè)���。
醫(yī)療器械分組可分為以下6類:
1. 單品(Single) 2.系統(tǒng)(System) 3. 家庭 (Family)
4.套裝 (Set) 5. 診斷試劑盒(IVD Test Kit) 6. 體外診斷產(chǎn)品(IVD Cluster)
三��、認(rèn)證模式
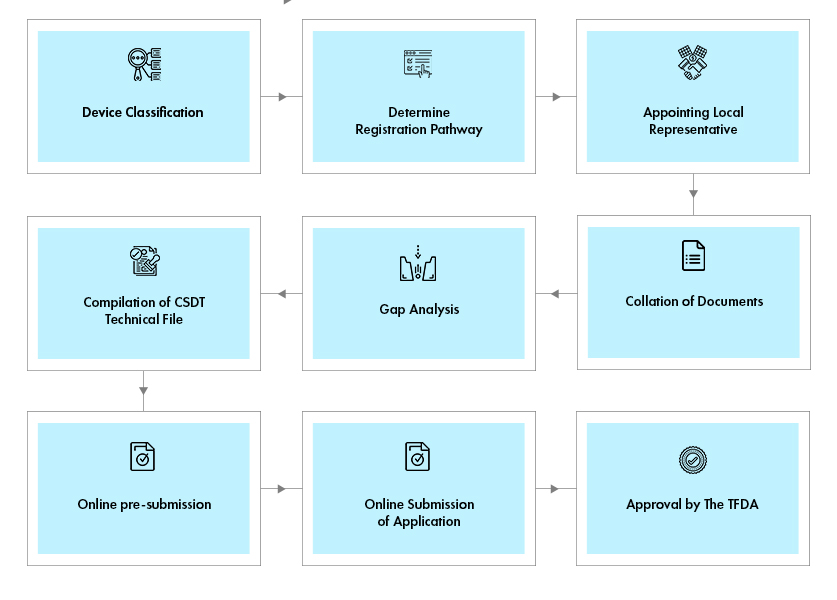
低風(fēng)險(xiǎn)的普通 I 類設(shè)備必須在泰國進(jìn)口和銷售之前列名����,而 II 類和 III 類設(shè)備必須先通過文件預(yù)審��,IV 類設(shè)備必須獲得批準(zhǔn)的許可證才能投放泰國市場(chǎng)���。
II�、III 和 IV 類器械需要按照東盟 CSDT 格式提交技術(shù)檔案��。I 類無菌和測(cè)量設(shè)備需要提交測(cè)試報(bào)告才能將這些設(shè)備投放市場(chǎng)。
1. I類設(shè)備備案所需文件:
(1) 載明醫(yī)療器械名稱和說明��、標(biāo)簽��、產(chǎn)品規(guī)格���、醫(yī)療器械生產(chǎn)信息或者產(chǎn)品
(2) 所有人詳細(xì)信息的文件,包括醫(yī)療器械附注文件����;在有醫(yī)療器械文件的情況下。
(3) 在境外注冊(cè)的境外注冊(cè)歷史文件����;
(4) 生產(chǎn)或者進(jìn)口無菌醫(yī)療器械的無菌試驗(yàn)證明文件;
(5) 用于測(cè)量的醫(yī)療器械生產(chǎn)或者進(jìn)口時(shí)的測(cè)試或者校準(zhǔn)證明文件���;
(6) 產(chǎn)品生產(chǎn)者或者所有者的產(chǎn)品合格證明��;
(7) 產(chǎn)品所有人在提交醫(yī)療器械進(jìn)口申請(qǐng)時(shí)作為代理人的授權(quán)書���;
2. II類/III/IV類設(shè)備通知所需文件:
(1) 醫(yī)療器械的名稱和說明文件、醫(yī)療器械的標(biāo)簽和標(biāo)簽文件����、醫(yī)療器械的摘要���、醫(yī)療器械的生產(chǎn)信息或者產(chǎn)品所有人的詳細(xì)信息;
(2) 醫(yī)療器械安全性和功能性的主要原則及其一致性證明方法的文件��;
(3) 風(fēng)險(xiǎn)分析文件�;
(4) 質(zhì)量體系證書;
(5) 產(chǎn)品生產(chǎn)者或者所有者的使用目的���、適應(yīng)癥��、包裝�����、標(biāo)簽證明和使用方法證明�����;
(6) 產(chǎn)品生產(chǎn)者或者所有者的產(chǎn)品合格證明�;
(7) 生產(chǎn)企業(yè)或者產(chǎn)品所有人的醫(yī)療器械銷售記錄證明�����;
(8) 其他證明文件